2.3.1 H2O-H2-O2-H+-OH-体系的E-pH图
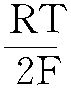
如上所述,水溶液腐蚀具有电化学反应的本质。有H+和OH-离于参加的电化学反应是同金属腐蚀过程关系最密切的两个电极反应。
(1) 氢电极反应 H2⇔2H++2e。 这个电极反应的标准电极电位等于零,即E0=0,因此它的平衡电位可表示为:
E0(H2/H+)=ln=0.0591 1g
由于pH=-lgaH+,当pH2=1个标准大气压时,上式可改写为:
E0(H2/H+)=-0.0591pH
(2)氧电极反应 4OH-⇔O2+2H2O+4e。在稀溶液中,可以认为水的活度αH2O是一个定值。因此,在一定的温度和压力下稀溶液中水的化学位μH2O也是一个定值,可将它同其他物质的标准化学位一起归入标准电极电位E0项。这样,氧电极反应的平衡电位可表达为:
E0(OH-/O2)=Eo0(OH-/O2)+ln
已知 ...... (共937字) [阅读本文]>>

 上一篇
上一篇
.jpg)
.jpg)
.jpg)
