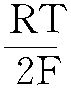2.2.2 平衡电极电位与能斯特方程式
设电化学反应通式为:
νAA+νBB⇔νCC+νDD+ne
反应式的左边是还原态,右边是氧化态。电化学反应总是伴随着电荷的转移过程进行的。在电荷转移与反应物的变化量之间存在严格的等当关系,服从法拉第定律。
电化学反应的平衡条件可表达为:
νi·i=0
式中i是溶液中i组分的电化学位。电化学位与化学位之间存在以下关系:
i=μi+niF·∅i
若i组分荷正电,则在等式右边第二项前取正号;若i组分荷负电,则在等式右边第二项前取负号。右边第二项中F为法拉第常数,∅i为i组分内电位。
根据电化学反应平衡式可知,当电极反应是阳极反应时,νii<0i;当电极反应是阴极反应时,νii>0。
设E0为电化学反 ...... (共1035字) [阅读本文]>>

 上一篇
上一篇
.jpg)
.jpg)
.jpg)